歷經1971至2005年共三十幾年研究,科學家不僅從過去模糊的「高分子多糖體」,逐步釐清到「活性多糖肽」的概念,更找到這類活性成分調控免疫的直接證據。
文/許瑞祥
◎ 本文原載於2006年1月《健康靈芝》第31期26~29頁
1997 年韓國 Wonkwang 大學 Park 等人發表以靈芝多糖體抗肝纖維化的研究結果,發現在小鼠體內利用膽管結紮誘導肝纖維化的試驗模式下,靈芝多糖可有效降低血清中 aspartate transaminase(AST,即 GOT)、alanine transaminase(ALT,即 GPT)、alanine phosphatase(ALP)和膽紅素值,並可減低膠原蛋白在肝臟中的含量,此結果顯示靈芝多糖體用於保肝藥物的開發是具有潛力的。
1999 年韓國原子能研究所 Kim 等人發表靈芝(G. lucidum)子實體熱水萃取的多糖體,具有抗超氧自由基傷害之能力,在體外的試管中對 DNA 有良好的輻射傷害保護能力,以及對抗氫氧自由基所誘發 DNA 斷裂的能力。結果顯示,靈芝可以為人類預防因自由基的攻擊而引發的相關疾病,無論是癌症或是老化的發生,均能提供有效的預防途徑。
同年,韓國 Chungbuk 大學 Eo 等人發表靈芝多糖體抗疱疹病毒的系列研究,結果顯示靈芝子實體經熱水萃取而得的多糖體中含有不同蛋白質鍵結的組成分,對於抗疱疹病毒的活性亦有差別。
在體外試驗中,以溶菌斑減少法評估其對抗疱疹病毒Ⅰ型(HSV-1)和Ⅱ型(HSV-2)的活性,其中以含酸性蛋白質的多糖體具有最強的抗病毒能力,在 Vero 和 HE1-2 細胞株中 EC50 值為 520 μg/ml,作者認為具有開發成新抗疱疹藥物的價值。
2002 年,同樣的研究團隊發表以此酸性蛋白鍵結的多糖體(APBP)搭配核苷型的抗疱疹藥物Acyclovir(ACV)和 Vidarabine(ara-A)組合使用的抗病毒效果,利用 Combination Index(CI)值來評估多種藥物共同使用的效果,結果顯示 APBP 和 ACV 的 CI 值為 0.47~0.51,而 APBP 和 ara-A 的 CI 值則為 1.02~1.18。
此結果顯示,APBP 和 ACV 具有明顯抗 HSV-1 和 HSV-2 的協同作用,以此靈芝多糖搭配抗疱疹藥物使用,不但可以減少使用劑量,亦可以提升其抗病毒效果,為靈芝搭配現有藥物的使用提供有利的佐證。
同年,該團隊的 Kim 等發表以此 APBP 搭配蛋白質型的抗病毒劑干擾素-α(Interferon-α, INF-α)和干擾素-γ(INF-γ)的效果,以 CI 值來評估不同組合抗疱疹病毒的結果,其中APBP 和 INF-α 對 HSV-1 和 HSV-2 的 CI 值為 0.3 和 0.62,APBP 和 INF-γ 對 HSV-1 和 HSV-2 的 CI 值為 0.65 和 1.10。
此結果顯示,APBP 和 INF-α 的協同抗病毒作用較為明顯,為靈芝多糖搭配干擾素使用於病毒的防治提供有效的證據,同時對於使用干擾素治療的過程中,配合靈芝的共同作用,將可使干擾素的效果更為明顯。
2002 年 Eo 等發表 APBP 抗疱疹病毒的作用機制,發現 APBP 在 100 和 90 μg/ml 時可以抑制 50% HSV-1 和 HSV-2 病毒附著於 Vero Cells 細胞上,同時可以阻止病毒滲透到Vero Cells 中。此結果顯示,APBP 的抗病毒機制是經由結合細胞表面的 HSV 專一性附著的糖蛋白位置,阻礙了病毒和細胞接觸的管道後,降低病毒入侵細胞膜的機率。
由靈芝多糖體抗人類疱疹病毒的系列研究成果,可見靈芝的熱水萃取物能阻止病毒和細胞的專一性結合,減低細胞感染病毒的機會,同時在受到病毒感染的細胞以抗病毒藥物治療時,亦能與其發揮協同作用,提升藥物的效果。此結果對於靈芝多糖體應用價值的確認,無論是預防或是治療產品的開發,都有不可替代的重要性。
2002 年中研院由翁啟惠院士主導的靈芝研究團隊,開始發表有關靈芝多糖體的系列研究成果。靈芝(G. lucidum)子實體經 0.1N NaOH 溶液萃取之上清液經中和後以乙醇沉澱的粗萃取物,其組成分析結果以葡萄糖(58%)和甘露糖(15.5%)為主,並含有岩藻糖(9.7%)、半乳糖(9.3%)和木糖(5.4%)等醣類外,並含有約 15.6% 的蛋白質。此粗萃取物再經以膠體濾管柱層析後,回收得到 5 個主要含醣的部分。
以小鼠脾細胞增生試驗評估其主要作用的活性表現在第三部分(F3),在有效濃度為 0.01~1.1 μg/ml 時,對脾細胞有明顯的增生作用,而原粗萃取物則需 0.1~1μg/ml 方可達到相同的效果。
以二維電泳分析小鼠脾細胞經 F3 處理後的蛋白質體變化時發現,約有 50% 的蛋白質產生變化。F3 促進脾細胞的增生外,同時亦可增加 IL-1、IL-2 和 INF-γ 的表現。作者強調在此多糖組成中的岩藻糖,對於活性的存在是必要的。
此篇論文顯示,國內研究已經從基因體學進入到蛋白質體學的領域,對於活性多糖體的組成與構形具備精確描述的能力,同時顯示此活性多糖是與蛋白質相結合的聚合物。
2004 年該團隊中的 Chien 等發表以 F3(10~100 μg/ml)處理人類臍帶血 7 天後,分析其中巨噬細胞、樹突細胞和自然殺手細胞的細胞數目後,發現比未經 F3 處理的對照組分別增加 2.9、2.3 和 1.5 倍。此外,B 細胞數目沒有明顯的差別,但 T 細胞在 F3 處理下降低 20%左右,經 F3 處理後的自然殺手細胞,其毒殺癌細胞的能力增強 31.7%。
由此體外分析結果,確定含蛋白質的靈芝多糖F3不會傷害人類的免疫細胞,卻可以促進細胞的增殖與提升其毒殺癌細胞的能力。另外,在本篇中首度提到靈芝多糖體能刺激人類臍帶血中免疫細胞增殖的作用,提升來源與保存不易的臍帶血在將來應用的可能性。
同年,該團隊的 Chen 等發表將此具有活性的多糖體 F3,再經陰離子交換管柱層析詳細分為F3G1(11%)、F3G2(10%)和 F3G3(11%)三部分,期待能找尋更小分子量的活性多糖體。
經以對小鼠脾細胞誘導生成細胞激素的模式來評估其活性的表現,結果發現 F3 能活化 IL-1、IL-6、IL-12、INF-γ、TNF-α、GM-CSF、G-CSF 和 M-CSF 等多種細胞激素。其中的 IL-1、IL-6 和 INF-α(前述不含此激素)與發炎反應有關,INF-γ、TNF-α 與抗腫瘤活性有關,GM-CSF、G-CSF 和 M-CSF 則與造血機能有關。
將 F3 再往下細分所得的各組分析結果:F3G1 只能活化 IL-1、IL-12、TNF-α 和 G-CSF 四種細胞激素,F3G2 和 F3 相同能夠活化前述8種細胞激素,F3G3 則只能活化 IL-1 和 TNF-α 兩種,結果顯示 F3G2 和 F3 有相同的作用機制與活性,但 F3G2 的分子量明顯較 F3 為低。
作者等在論文中雖未曾提及有關 F3G2 和 F3 在組成與構形分子量間的差別,但就此結果而言,具有啟動免疫調節能力的多糖體,其基本結構已被精確掌握,從靈芝的粗萃取物中可精製純化得到多少量的 F3G2 是可以計算的。
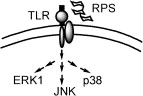
同年該研究團隊並確認,靈芝多糖體啟動免疫調節的關鍵,是經由細胞表面特定受體來達成的。陽明大學許先業教授所發表的論文中證實,F3 是經由與巨噬細胞表面 TLR4 受體的結合來啟動細胞內 IL-1 基因的表現,不但排除其他來源的 LPS 干擾,亦推翻過去認為是經由Complement receptor type 3 啟動的說法。
無論是人類或小鼠的巨噬細胞,F3 皆可經由細胞表面上的 TLR4 受體,向細胞內調控 IL-1 表現相關的基因與酵素。在細胞分子層級的分析結果中可見,當 F3 與 TLR4 受體結合後,立刻活化細胞內的 PKC、MEK1、PAK、MAPKs 等酵素系統,將不同的訊息向細胞核傳遞,進而引發多種細胞激素的生成。
本文中以 IL-1 的表現與調控為指標,建立評估活化或啟動路徑的網路團,對於 IL-1 基因於表現前轉錄與 F3 調控後轉錄的 pro-IL-1,到 IL-1 的生成與分泌至胞外的過程,皆有清楚的瞭解,對於靈芝多糖體於細胞外如何經由特定 TLR4 受體來啟動胞內的基因表現,生成細胞激素後分泌到胞外參與免疫調節的過程,有更精確的認識。
大約在同時期,另一組台大醫學院和陽明大學合作的團隊亦發表系列多糖體的研究成果。2002 年 Hsu 等發表以靈芝多糖體延長白血球的存活時間來增強免疫能力的論文,由靈芝(G. lucidum)子實體經熱水萃取、酒精沉澱的粗多糖,再經過膠體管柱層析與陰離子交換樹脂管柱分離純化所得的高分子多糖體代號為 PS-G,經詳細的組成分析確認 PS-G 應該是由 95% 的多糖體和 5% 的胜肽所結合而成的多糖肽,同時已知此 PS-G 不含細菌內毒素,以排除受 LPS 污染的干擾。
作者等研究 PS-G 對嗜中性白血球存活率的影響,是透過抑制自發性凋亡現象達到的。嗜中性白血球是重要的免疫細胞之一,主導寄主抗菌與吞噬的能力,此白血球從骨髓釋放到循環系統中只有 6~10 小時的生命期,受到自發性凋亡程序來調控其生命的長短。研究發現,PS-G 能拮抗由 Akt-regulated signaling pathways 所引發的白血球凋亡作用,延長白血球存活時間來增強寄主免疫力。
2005 年 Lin 等發表以此多糖肽 PS-G 啟動人類樹突細胞的機制,證實 PS-G 亦是經由樹突細胞表面的 TLR-4 受體將訊息傳入細胞內,使負責訊息的蛋白分子 NF-KB 和 p38MAP 等傳遞途徑加速樹突細胞成熟,同時合成並分泌細胞激素 IL-12。IL-12 不僅能增強自然殺細胞和 T 細胞噬菌的能力,促使自然殺手細胞分泌 INF-γ 外,還能誘導 T 細胞朝向 Th1(第一型免疫反應)分化。
靈芝多糖體啟動免疫訊息的起始點,在人類樹突細胞的研究模式中再次獲得證實,就作者的描述 PS-G 和 F3 都是含有蛋白質的多糖體,其來源不同,分離純化條件各異,雖然皆未標示活性多糖體的分子量大小,但就無論是巨噬細胞或是樹突細胞,皆以 TLR-4 受體結合後開始啟動免疫訊息的結果而言,此兩種活性多糖肽的基本構造必定是相似的。
中國北京大學藥學系林志彬教授組織的研究團隊,在此時期有關靈芝多糖體的研究亦大放異彩。在其系列相關研究所用的材料是以靈芝(G. lucidum)子實體經熱水提取、酒精沉澱、透析與去蛋白質等程序後所得的Gl-PS(G. lucidum polysaccharide),對應於子實體乾重的產率為 0.82%。
此多糖經精密的組成分析後,確認應該是多糖肽(polysaccharide peptide),其分子量為 584,900,多糖和肽的比例為 93.51:6.49。其中多糖由鼠李糖(rhamnose)、木糖(xylose)、果糖(fructose)、半乳糖(galactose)、甘露糖(mannose)和葡萄糖以 0.793:0.964:2.944:0.167:0.384:7.94 比例組成,多肽的部分則由17種胺基酸所組成。
2002 年該團隊 Cao 等發表以 Gl-PS 處理樹突細胞後,不但能加速其成熟,同時可以誘導毒殺性 T 細胞(Cytotoxic T-lymphocytes, CTL)細胞毒性的生成,是經由 INF-γ 和 Granzyme B pathways 來調控。
2003 年 Zhang 等發表 Gl-PS 無論在體內或體外試驗結果,顯示 Gl-PS 可以保護胰島 β cells 不受自由基的傷害,為多糖體抗自由基活性提供另一項有利的佐證。
2004 年 Shao 等針對靈芝多糖體啟動免疫反應的受體位置發表其研究成果,以 Gl-PS 處理能活化 BALB/c 小鼠的 B 細胞和巨噬細胞,但不能活化 T 細胞;TLR-4 受體突變的 C3H/HeJ 小鼠的 B 細胞則無法被 Gl-PS 活化。
作者發現利用抗小鼠 TLR-4 的單株抗體可以有效抑制被 Gl-PS 刺激後 BALB/c 小鼠 B 細胞的增殖現象。綜合以上結果可知,TLR-4 受體是 Gl-PS 活化 B 細胞的必要媒介。
在巨噬細胞的試驗結果,Gl-PS 可以誘導 BALB/c 小鼠腹腔巨噬細胞產生 IL-1β,但對於 TLR-4 受體缺損的 C3H/HeJ 小鼠則無法產生誘導作用,顯示 Gl-PS 活化巨噬細胞時需要有 TLR-4 受體的參與。
本論文以細胞表面具有 TLR-4 受體與不具 TLR-4 受體的 B 細胞和巨噬細胞互相交互驗證,靈芝多糖體要調控免疫,確實是經由 TLR-4 受體結合後向胞內傳遞訊息。
自 1970 年開始有關靈芝活性成分的研究報告中,多糖體一直是被探討的主角,從開始的抗腫瘤(S-180)活性到提升免疫功能,1990 年從細胞激素的消長瞭解靈芝多糖體具備免疫調節功能。
時至今日,對於啟動免疫反應所需的特定受體與訊息傳遞途徑已有明確的結果,無論是樹突細胞、巨噬細胞或是 B 細胞,被活性多糖肽 Gl-PS、PS-G、F3 等啟動的皆為細胞表面的 TLR-4受體,為高分子量的多糖參與免疫調控找到直接的證據,同時也讓我們從過去模糊的高分子多糖體,逐步釐清到活性多糖肽的概念。
確實有效多糖肽的基本構造或許仍然未知,或許是重要的商業機密,但對大部分的讀者而言,瞭解靈芝功效中抗癌、抗氧化、抗病毒、降血糖、護肝與免疫調節等,皆來自於特定組成與構形的多糖肽。
當我們受益於不斷提升品質的靈芝產品時,更應該對三十多年來埋首研究靈芝多糖體的各國精英表達無限的敬意與謝忱。由於篇幅有限,本人謹對許多尚未被引用的遺珠之憾表達歉意。
COPYRIGHTS © Ganodermanews SINCE By 2015 ALL RIGHT RESERVED.
靈芝新聞網 版權所有 | 本網站內容作者享有其著作權,禁止侵害,違者必究
Powered by
ganodermanews.com