對於一再突變,甚至是一再對EGFR標靶藥出現抗藥性的突變型EGFR肺腺癌,只能換個標靶姿勢再治一次,還是走回傳統化療的老路?中山醫學大學醫學研究所柯俊良教授率其團隊成員辛翌綸博士、康于庭博士(台中榮民總醫院博士後研究員)等發表在2024年12月號《Environmental Toxicology》的研究讓我們看到了另一種因應的可能性,那就是既能顧前(清除EGFR)也能顧後(阻止癌細胞透過「整合素」另謀生路)的小孢子靈芝免疫調節蛋白質GMI(Ganoderma microsporum immunomodulatory protein)。
文/吳亭瑤

簡稱EGFR的「表皮生長因子受體」是眾多位於細胞表面的接受器之一,它可以接收多種外來信號,活化細胞內的相關分子來驅動細胞增生。正常細胞對EGFR的表現量和活性會嚴格調控,可是有些癌細胞會卻把EGFR當成利器,將其大量表現(即所謂的EGFR陽性)加快增生速度;甚或發展出突變的EGFR,毋須等待外來信號就能自行運作,讓細胞長得更快更多也更具侵襲性。
EGFR最常見的突變是L858R,意指EGFR這個蛋白的第858個胺基酸由亮胺酸(L)突變為精胺酸(R),其具體位置在EGFR位於細胞內部另一端的酪胺酸激酶區域。第一代標靶藥(吉非替尼/艾瑞莎、厄洛替泥/得舒緩)和第二代標靶藥(阿法替尼/吉泰瑞)均是專門針對這種突變而設計,藉由與酪胺酸激酶的活性位點結合,阻斷EGFR的訊息傳遞,抑制細胞增生。
然而經過一段時間治療之後EGFR通常會再次發生T790M突變,也就是第790個胺基酸從原本的蘇胺酸(T)變成了甲硫胺酸(M),導致前兩代EGFR標靶藥無法與酪胺酸激酶的活性位點順利結合而失去效用。本研究使用的人類肺腺癌細胞H1975就具有EGFR雙突變(L858R/T790M)的特性。
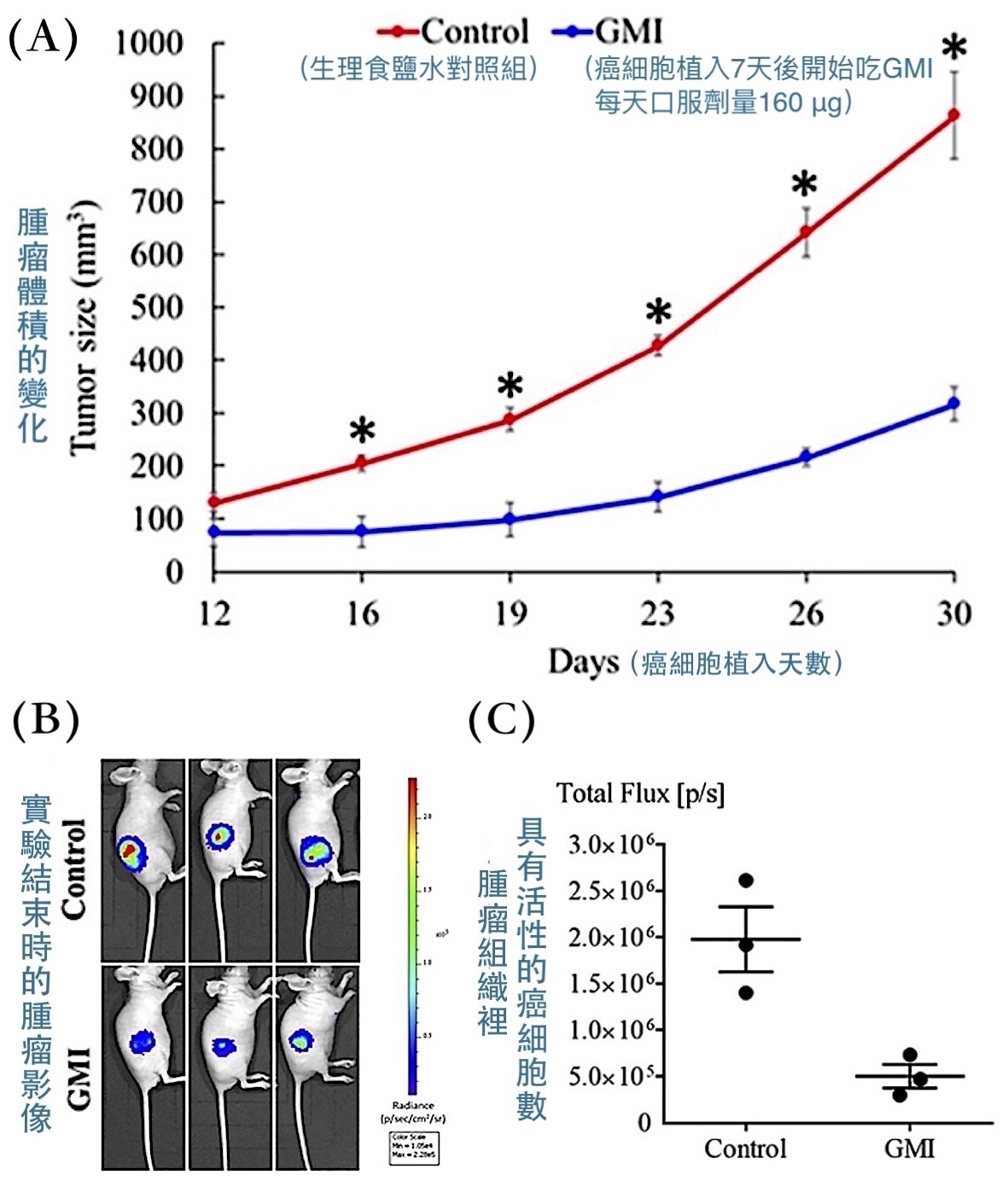
把H1975細胞注射到裸鼠(免疫有缺陷的小鼠)右側腹皮下組織,一週後再以口服方式每天給予160 μg GMI或生理食鹽水,結果GMI組的腫瘤不只長得慢、體積小,腫瘤組織裡具有活性的癌細胞也比較少【圖1】。這說明GMI是一個可以經由胃腸道發揮抗腫瘤作用的活性成分,而且可以在免疫不彰的體內環境下獨力抑制H1975細胞增生。
體外模擬細胞遷移的實驗則顯示,H1975細胞的遷移能力【圖2-①】會在轉化生長因子TGF-β誘導下變得更強【圖2-③】,不過只要同時有GMI(0.3 μM)存在,不管有【圖2-④】或沒有【圖2-②】TGF-β誘導,癌細胞從兩旁移至中間無細胞區的數量均會下降,顯示GMI有抑制H1975細胞遷移的作用。

學名為奧希替尼(osimertinib)、商品名為泰格莎(Tagrisso)的小分子化合物,是專門設計來對付EGFR雙突變(L858R/T790M)癌細胞的第三代標靶藥。與前兩代標靶藥類似,奧希替尼也是透過與EGFR的酪胺酸激酶區域結合(但結合位點跟前兩代不同)來抑制癌細胞增生,而且也同樣難以避免幾個月後EGFR再次突變導致藥物失效的問題。
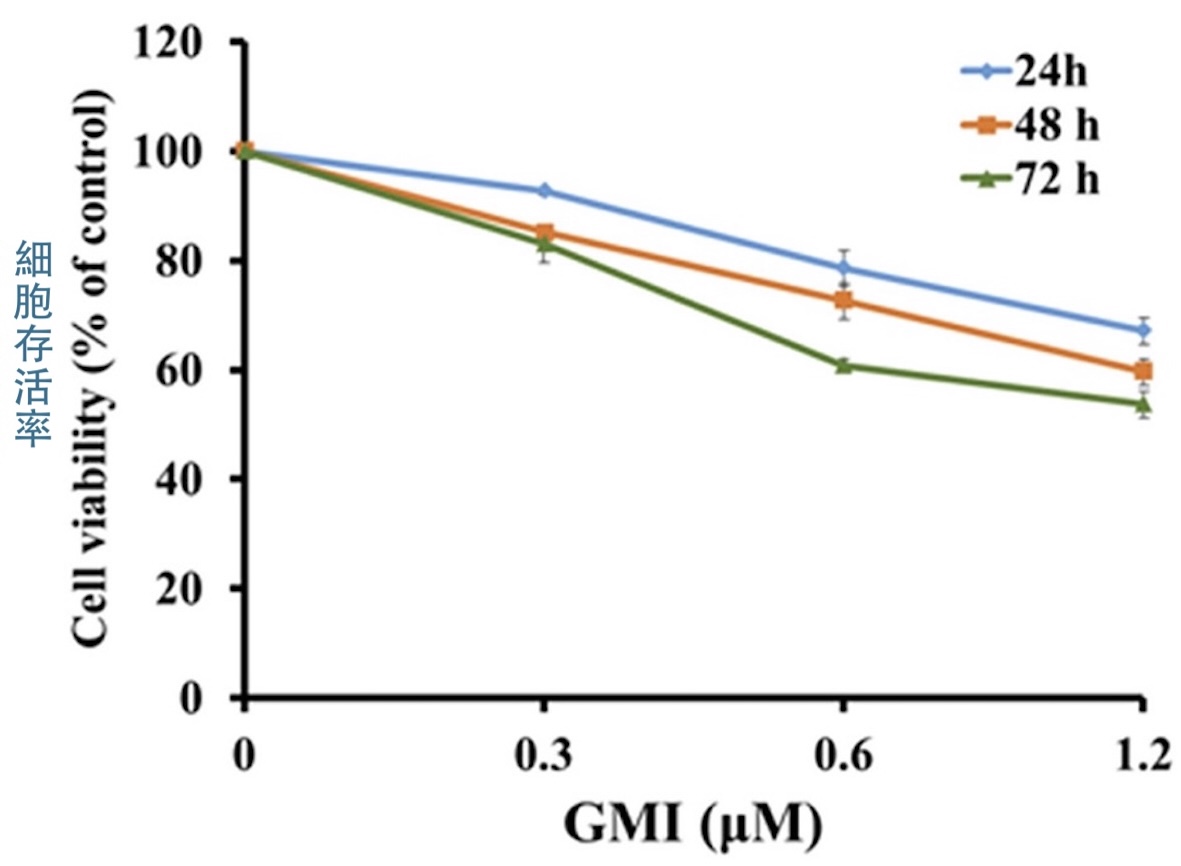
為了了解GMI是否也能對付這樣的癌細胞,本研究利用H1975細胞建立了「EGFR雙突變但對奧希替尼有抗藥性」的人類肺腺癌細胞H1975/TR,結果發現,H1975/TR的存活率會隨GMI的使用濃度與作用時間而降低【圖3】,這說明GMI對H1975/TR細胞具有一定的殺傷力,也暗示GMI的作用機制有別於現有的EGFR標靶藥。
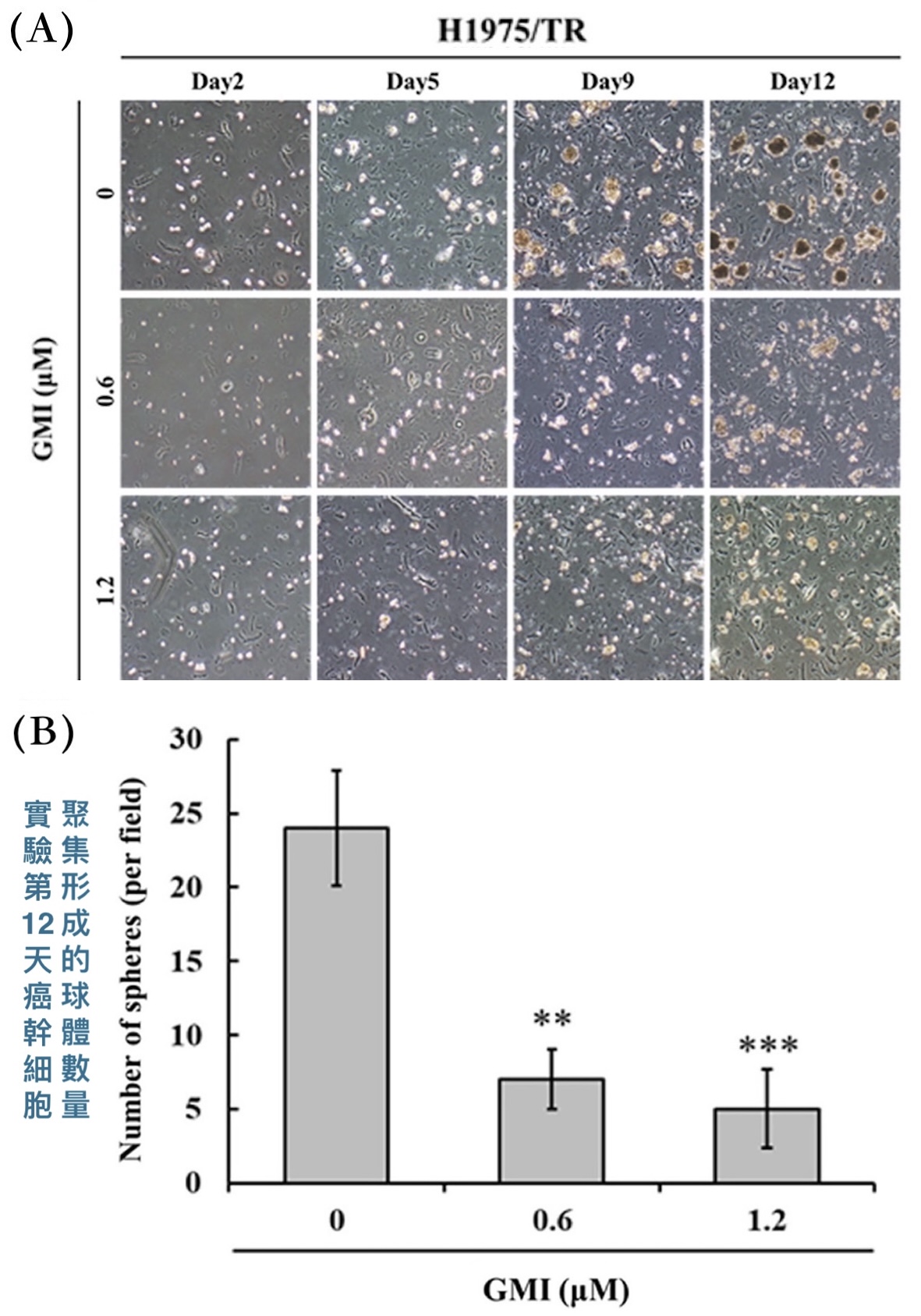
除了透過EGFR突變讓標靶藥失效,癌幹細胞也是抗藥性的一大來源,其在整體癌細胞裡的占比常與抗藥性呈負相關。可是本研究的H1975/TR細胞在跟GMI一起培養12天之後,癌細胞聚集形成的腫瘤球體(tumor spheres)的數量明顯少於沒有GMI處理的組別【圖4】。形成腫瘤球體只有癌幹細胞才做得到,一般癌細胞無此能力,因此實驗結果說明GMI對癌幹細胞也有效——不是能夠阻止一般癌細胞發獲得幹細胞特性,就是可以抑制既有的癌幹細胞增殖。
癌症的本質是「細胞生長失控」。對於大量表現EGFR的肺腺癌細胞來說,EGFR就是那個造成失控的開關,因此把EGFR「卡住」,讓它無法啟動細胞增生相關的訊息通路,自然成為標靶藥的設計核心。但也因為標靶藥的藥效跟EGFR的結構息相關,而癌細胞又會靠EGFR突變來掙脫束縛,使得標靶治療宛如一場計畫永遠趕不上變化的結構競賽。
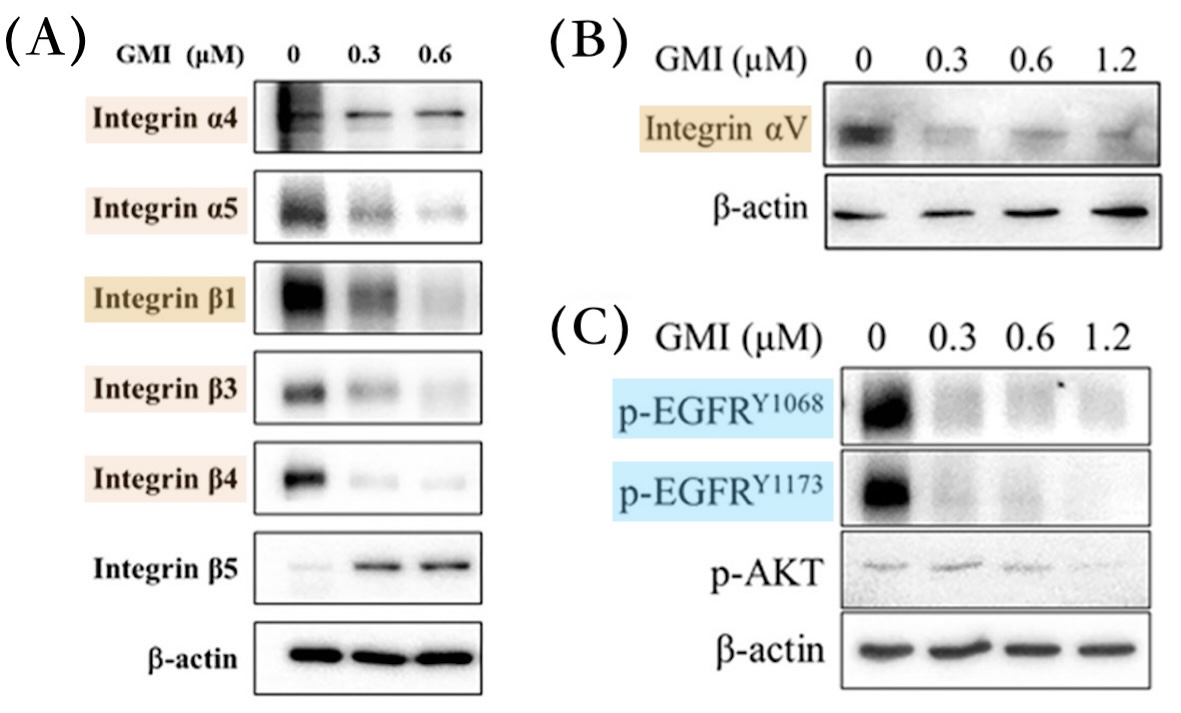
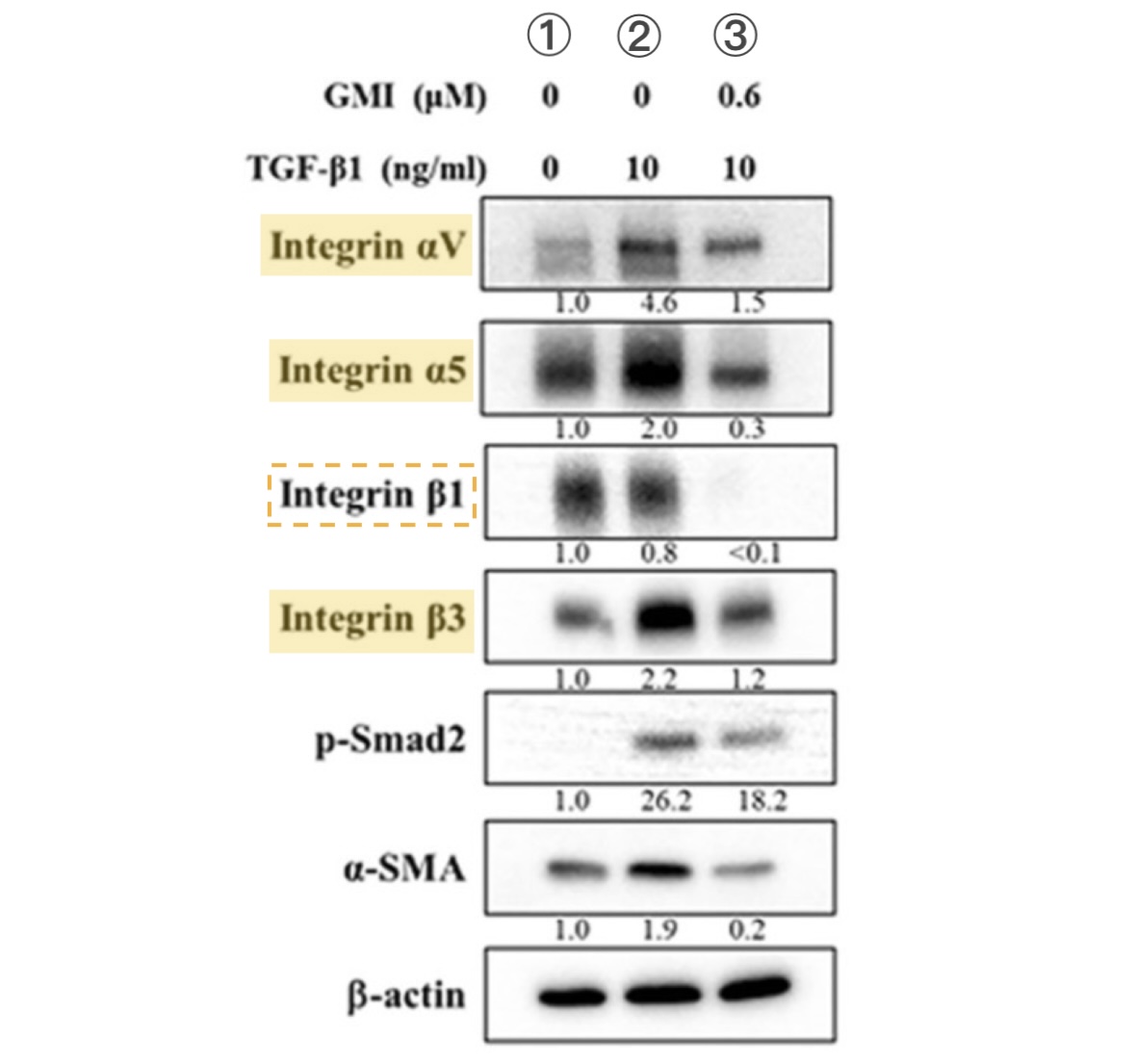
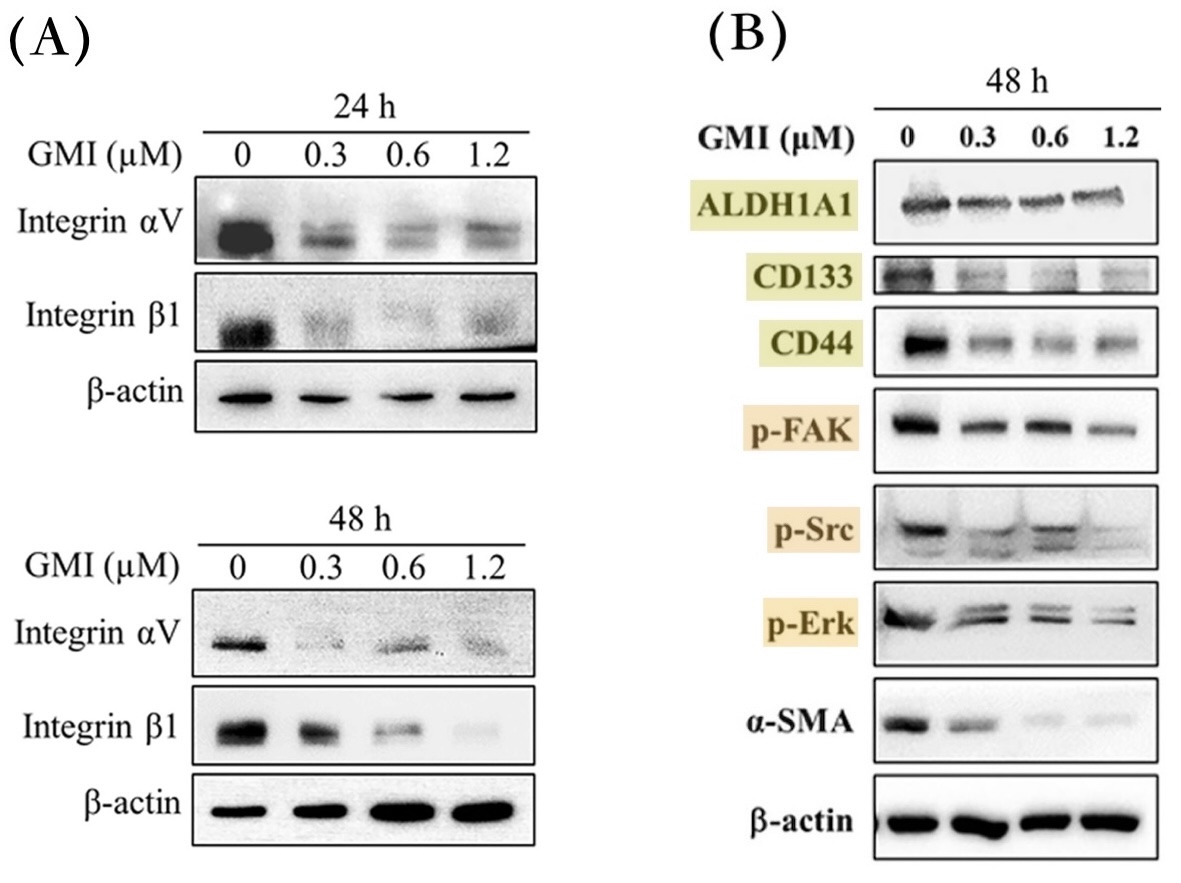
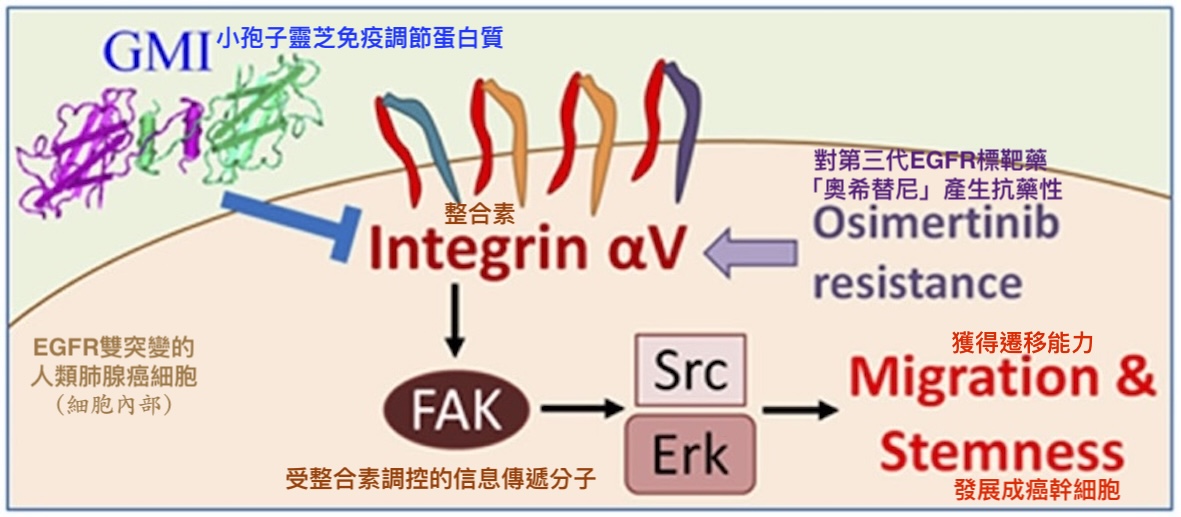
相較之下,GMI化細胞生長失控為可控的做法比較像是斧底抽薪。根據本研究的實驗顯示,GMI不僅會讓突變的EGFR從癌細胞表面消失,還會順勢清除或抑制另一群常被EGFR突變癌細胞拿來另闢蹊徑而大量表達的受體——整合素(integrins)——使癌細胞無法透過這些「備用開關」繼續失控地快速增生、向外遷徒(轉移),甚至發展成癌幹細胞【圖5-7】。
成員眾多、兩兩一組(α型+β型)一起工作的整合素有很多功能,除了可以像鉤子一般幫助細胞穩定附著在周圍組織(細胞外基質ECM),也可以像感應器那樣接收周圍環境的訊息來影響細胞的行為(例如增生或遷移),甚至是細胞遷移時實際負責移動的「腳」。但就如同EGFR的問題一樣,本應受到嚴格調控的整合素卻常被癌細胞過度表現,對癌症治療帶來不利的發展。
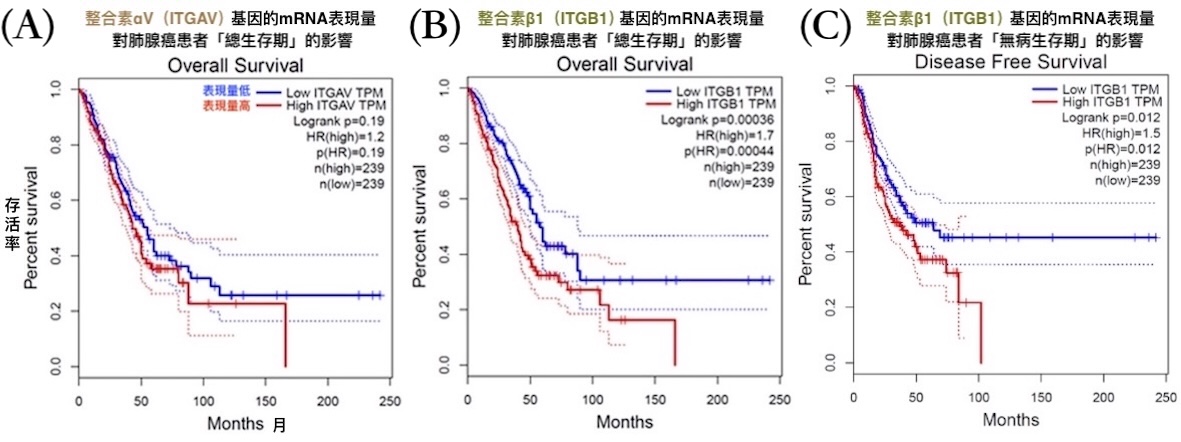
本研究根據癌症基因資料庫OncoDB的數據進行分析發現,肺腺癌患者比一般人的肺組織有更高的整合素αV基因表現量;癌幹細胞分子標記CD44的基因表現量,與整合素αV、β1的基因表現量都有呈正相關。此外,透過基因表達分析工具GEPIA得到的結果則顯示,整合素αV和β1的mRNA表現量越高,對肺腺癌患者的生存越不利【圖8】。
其他相關研究則證實,當EGFR突變的肺腺癌細胞遭受標靶藥挑戰時,會透過大量表現整合素αV和β1來活化細胞內部的訊息傳遞分子(如FAK、Src等),增強癌細胞的存活能力,使其具備抗藥性【圖9】。此外,肺腺癌細胞的遷移能力也跟整合素αV、β1的表現量,以及被整合素活化的FAK活性呈正相關。
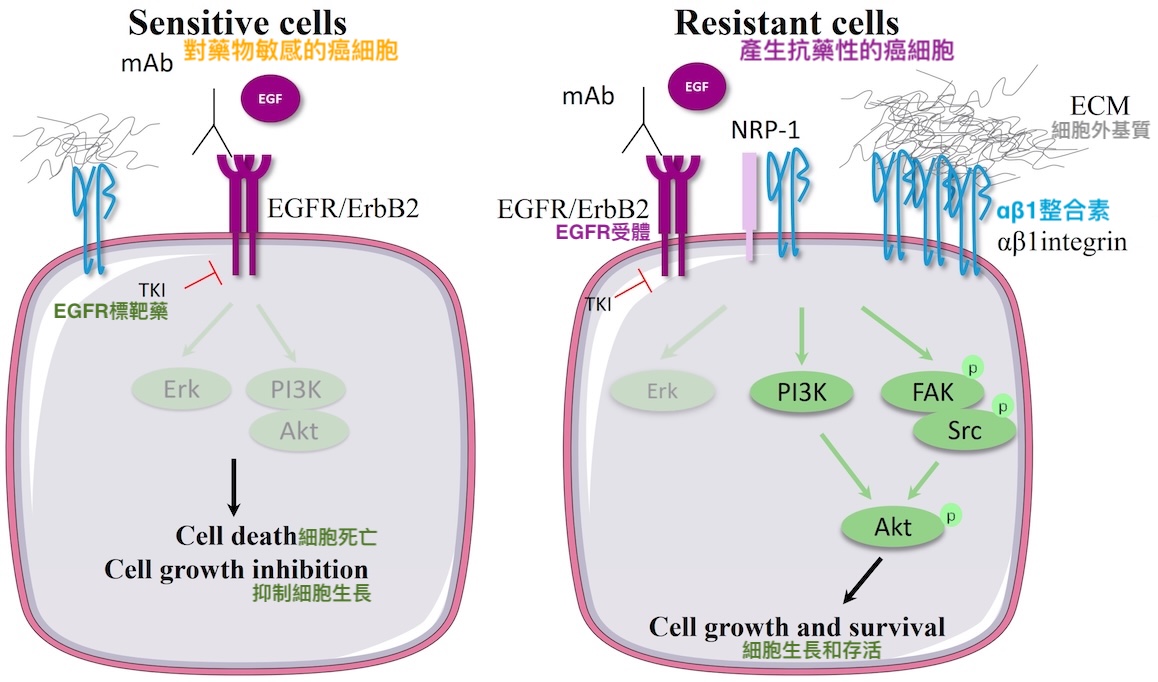
總的來說,整合素αV和β1不只有助EGFR突變的肺腺癌細胞產生抗藥性、增強遷移性、獲得癌幹性,臨床上還不利肺腺癌患者生存。
而在本研究裡的EGFR雙突變人類肺腺癌細胞,不論是對前兩代標靶藥有抗藥性的H1975細胞,還是在TGFβ誘導下增強遷移性的H1975細胞,或是對第三代標靶藥有抗藥性且具有顯著幹細胞特性的H1975/TR,都能因為GMI介入而減少細胞表面的整合素αV、β1【圖5-7】及細胞內FAK、Src、Erk分子的活性【圖7】。
此作用機制【圖9】對於GMI為什麼能抑制EGFR雙突變肺腺癌細胞的腫瘤生長、遷移能力、生存能力和癌幹細胞特性【圖1-4】提供了部分解釋——因為GMI能讓此路不通(被EGFR標靶藥阻斷)而山不轉路轉(大量表現整合素)的癌細胞,連替代道路(整合素調控的訊息傳遞路徑)也開通不了,或是即使開通也無法一路通暢到底(提高癌細胞獲得遷移能力和幹細胞特性的困難度)。
本研究揭示GMI可以經由調控整合素來抑制EGFR雙突變人類肺腺癌細胞的全新作用,跟陽明交通大學林東毅教授團隊2023年發表的研究成果頗有異曲同工之妙。該研究在小鼠肺腺癌細胞LLC-1(對第一代EGFR標靶藥有抗藥性)的動物實驗即觀察到,以腹腔注射方式進入體內的GMI不只抑制腫瘤生長,也能大幅減少腫瘤組織裡多種有利癌轉移的整合素(詳見相關報導:GMI抗肺腺癌轉移的分子機制新發現:讓癌細胞綁手綁腳,使其跑不了和尚也建不了廟)。
此外,本研究觀察到GMI可以讓突變型EGFR從人類肺腺癌細胞上消失的作用,也與陽明交通大學林東毅教授團隊2023年發表的研究成果一致,其箇中原理在林的論文亦有詳細闡述(詳見相關報導:GMI抑制EGFR陽性肺腺癌腫瘤的重要機制——迫使癌細胞吞掉自己的EGFR)。
如前所述,EGFR和整合素都是正常細胞會有的基本配備,差別在正常細胞只在需要時才把它們拿出來適度使用,用完之後就被細胞資源回收再利用;而癌細胞則是毫無限度地將它們大量表現、拼命使用,用到連旁邊的正常細胞也跟著「變壞」。從現有的研究結果看來,源自靈芝家族、結構渾然天成的GMI【圖11】顯然是讓癌細胞自廢武功,讓它們從失控的變態回歸到可控的常態。當失序的細胞少了,健康新秩序的重建應該也就不遠了。
〔資料來源〕Yu-Ting Kang, et al. Integrin αV Inhibition by GMI, a Ganoderma Microsporum Immunomodulatory Protein, Abolish Stemness and Migration in EGFR-Mutated Lung Cancer Cells Resistant to Osimertinib. Environ Toxicol. 2024 Dec;39(12):5238-5249. doi: 10.1002/tox.24399.
〔附圖文獻〕Cruz da Silva E, et al. Role of Integrins in Resistance to Therapies Targeting Growth Factor Receptors in Cancer. Cancers. 2019; 11(5):692.
COPYRIGHTS © Ganodermanews SINCE By 2015 ALL RIGHT RESERVED.
靈芝新聞網 版權所有 | 本網站內容作者享有其著作權,禁止侵害,違者必究
Powered by
ganodermanews.com